Công thức tính m hóa học tan
Độ tan là gì? Công thức tính chừng tan được VnDoc biên soạn tổ hợp lại nội dung định nghĩa chừng tan là gì, công thức tính độ tan cũng giống như những công thức biến hóa tương quan cho tới chừng tan. Từ cơ biết những áp dụng vô thực hiện những dạng bài bác tập dượt về chừng tan Hóa học tập.
Bạn đang xem: công thức tính độ tan
>> Mời chúng ta xem thêm thêm thắt một vài thắc mắc liên quan:
- Khi hạ nhiệt chừng và tăng áp suất thì chừng tan của hóa học khí vô nước
- Muối này tại đây ko tan vô nước
- Khi tăng sức nóng chừng và hạn chế áp suất thì chừng tan của hóa học khí nội địa thay cho thay đổi như vậy nào
I. Độ tan là gì?
Độ tan (độ hòa tan) của một hóa học được hiểu là số gam hóa học cơ tan vô 100g dung môi (thường là nước) muốn tạo trở nên một hỗn hợp bão hòa ở một ĐK sức nóng chừng mang lại trước.
Độ tan của một hóa học vô nước
Độ tan của một hóa học nội địa là số gam hóa học cơ hòa tan vô 100g nước muốn tạo trở nên hỗn hợp bão hòa ở sức nóng chừng xác lập.
II. Công thức tính chừng tan
Ví dụ: Tại 25oC Khi hòa tan 36 gam muối bột NaCl vô 100 gam nước thì người tao chiếm được hỗn hợp muối bột bão hòa. Người tao thưa chừng tan của NaCl ở 25oC là 36 gam hoặc SNaCl = 36 gam
* Phương pháp giải bài bác thói quen chừng tan:
Áp dụng công thức tính độ tan:
![]()
Trong đó:
mct là lượng hóa học tan muốn tạo trở nên hỗn hợp bão hòa
mdm là lượng dung môi (nước) muốn tạo trở nên hỗn hợp bão hòa
III. Những nguyên tố tác động cho tới chừng tan
Độ tan của hóa học rắn tùy thuộc vào sức nóng chừng. Phần rộng lớn tăng sức nóng chừng thì chừng tan của hóa học rắn tăng.
Độ tan của hóa học khí tùy thuộc vào sức nóng chừng và áp suất. Độ tan của hóa học khí tăng Khi hạ nhiệt chừng và tăng áp suất.
IV. Bảng tính tan nội địa của những Axit - Bazo -Muối
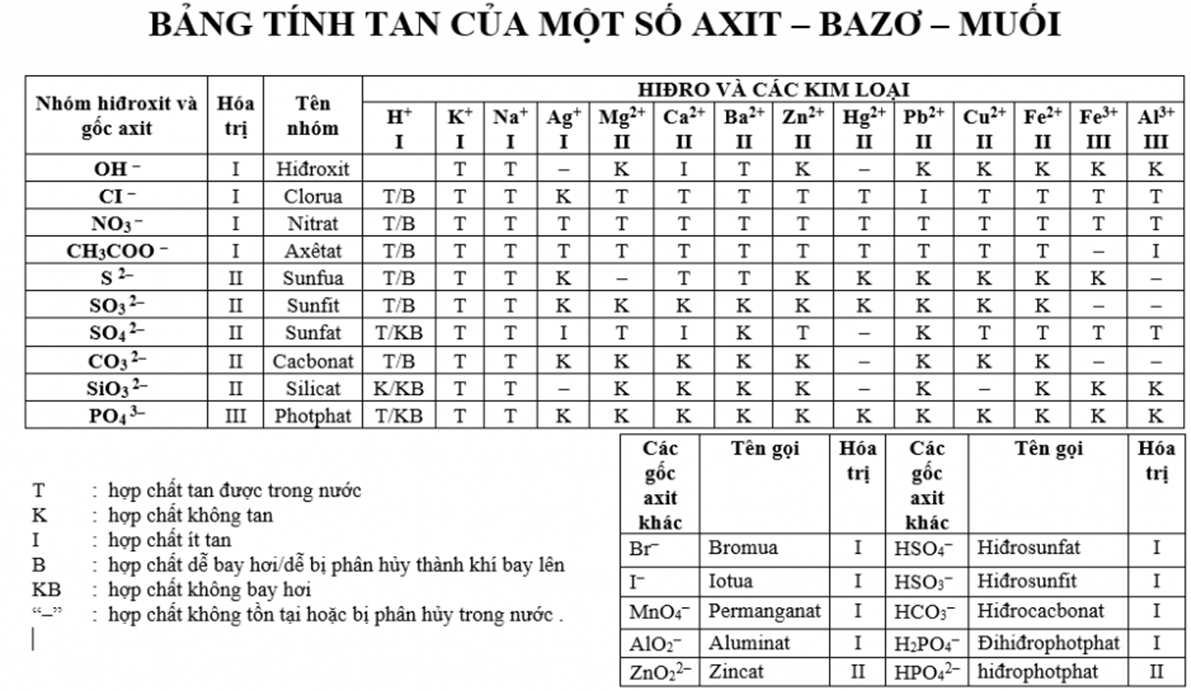
V. Bài tập dượt áp dụng liên quan
Ví dụ 1: Tính chừng tan của MgSO4 ở 20oC biết rắng ở sức nóng chừng này 360 ml nước rất có thể hòa tan tối nhiều 129,6 gam MgSO4 tạo nên trở nên hỗn hợp bão hòa
Đáp án chỉ dẫn giải cụ thể
Ta có: S = mct/mH2O .100 = 129,6/360 .100 = 36 (g/100g nước)
Ví dụ 2. Ở 25oC, chừng tan của NaCl là 36 gam. Thể tích nước cần thiết dùng làm hòa tan 1 mol NaCl ở nằm trong sức nóng chừng bên trên là bao nhiêu?
Đáp án chỉ dẫn giải chi tiết
Theo đề bài bác tao đem mNaCl = n.M = 58,5 gam
Ta có: mH2O = mct/S.100 = 58,5/36.100 = 162,5 gam
=> VH2O = 162,5 ml
Ví dụ 3. Xác ấn định chừng tan của Na2CO3 nội địa ở 18oC, biết ở sức nóng chừng này, hoà tan không còn 143 g Na2CO3.10H2O vô 250g nước thì được hỗn hợp bão hoà
Đáp án chỉ dẫn giải chi tiết
nNa2CO3.10H2O = 143/286 = 0,5mol
=> mNa2CO3 = 0,5.106 =53 gam
=> mH2O = 0,5.180=90 gam
Tổng lượng nước : 90 + 250 = 340 gam
S = 53/340.100 = 15,59
Vậy chừng tan của Na2CO3 ở 18oC là 15,59 gam
Ví dụ 4. Một hỗn hợp đem chứa chấp 26,5g NaCl vô 75g H2O ở 250C. hãy xác lập hỗn hợp NaCl thưa bên trên là bão hòa hoặc ko bão hòa? tường chừng tan của NaCl nội địa ở 250C là 36g.
Đáp án chỉ dẫn giải chi tiết
100g H2O ở 250C hòa tan 36g NaCl
75g H2O ở 250C hòa tan x?g NaCl
x = (75.36)/100 = 27 gam
Dung dịch NaCl tiếp tục điều chế là ko bão hòa.
Vì hỗn hợp này rất có thể hòa tan thêm: 27 - 26,5 = 0,5(g) NaCl ở 250C
Ví dụ 5. Độ tan của NaCl nội địa là 25oC là 44 gam. Khi mới nhất hòa tan đôi mươi gam NaCl vô 50 gam nước thì cần hòa tan thêm thắt từng nào gam NaCl sẽ được hỗn hợp bão hòa?
Đáp án chỉ dẫn giải chi tiết
Gọi lượng NaCl cần thiết hòa tan thêm thắt là m
=> Khối lượng NaCl hòa tan vô 50 gam nước muốn tạo dd bão hòa là: mct = m + 20
Ta có: mdm = 50 gam
Áp dụng công thức tính độ tan:
S = mct/mdm.100 => (m + 20)/50.100 = 44
=> m = 2 gam
VI. Bài tập dượt áp dụng tự động luyện
Bài tập dượt số 1: Ở 20oC, 60 gam KNO3 tan vô 190 nước thì chiếm được hỗn hợp bão hoà. Tính chừng tan của KNO3 ở sức nóng chừng cơ ?
Bài tập dượt số 2: ở 20oC, chừng tan của K2SO4 là 11,1 gam. Phải hoà tan từng nào gam muối bột này vô 80 gam nước thì chiếm được hỗn hợp bão hoà ở sức nóng chừng tiếp tục mang lại ?
Bài tập dượt số 3: Tính lượng KCl kết tinh anh đợc sau khoản thời gian thực hiện nguội 600 gam hỗn hợp bão hoà ở 80oC xuống 20oC. tường chừng tan S ở 80oC là 51 gam, ở 20oC là 34 gam.
Bài tập dượt số 4: Biết chừng tan S của AgNO3 ở 60oC là 525 gam, ở 10oC là 170 gam. Tính lượng AgNO3 tách đi ra Khi thực hiện giá buốt 2500 gam hỗn hợp AgNO3 bão hoà ở 60oC xuống 10oC.
Bài tập dượt số 5: Hoà tan 120 gam KCl và 250 gam nớc ở 50oC (có chừng tan là 42,6 gam). Tính lượng muối bột còn quá sau khoản thời gian tạo nên trở nên hỗn hợp bão hoà?
VII. Bài tập dượt trắc nghiệm về chừng tan
Câu 1. Khi tăng sức nóng chừng thì chừng tan của những hóa học rắn vô nước:
A. Đa số là tăng
B. Đa số là giảm
C. Biến thay đổi ít
D. Không biến đổi đổi
Câu 2. Bazơ ko tan?
A. Zn(OH)2
B. Ba(OH)2
C. Ca(OH)2
D. KOH
Xem đáp án
Đáp án A
Bazơ ko tan là Zn(OH)2
Còn lại Ba(OH)2, Ca(OH)2, KOH là những bazo tan
Câu 3. Độ tan của hóa học rắn dựa vào vào
A. Nhiệt độ
B. gí suất
C. Loại chất
D. Môi trường
Xem đáp án
Đáp án A
Độ tan của hóa học rắn tùy thuộc vào Nhiệt độ
Câu 4. Độ tan là gì
A. Số kilogam hóa học cơ tan được vô một lít nước muốn tạo đi ra dung dich bão hòa nhằm sức nóng chừng xác định
B. Là số gam hóa học cơ tan tối thiểu vô 100 g nước muốn tạo trở nên dung dich bão hòa ở sức nóng chừng xác định
C. Là số gam hóa học cơ tan tối đa vô 100 g nước muốn tạo trở nên dung dich bão hòa sức nóng chừng xác định
D. Là số gam hóa học cơ ko tan vô 100 g nước muốn tạo trở nên dung dich bão hòa ở sức nóng chừng xác định
Xem đáp án
Đáp án A
Độ tan là gì Số kilogam hóa học cơ tan được vô một lít nước muốn tạo đi ra dung dich bão hòa nhằm sức nóng chừng xác định
Câu 5. Chọn tóm lại đúng
A. Muối clorua đều là muối bột tan
B. Muối Fe là muối bột tan
C. Muối của sắt kẽm kim loại kiềm đều là muối bột tan
D. AgCl là muối bột tan
Câu 6. Khi tăng sức nóng chừng và hạn chế áp suất thì chừng tan của hóa học khí nội địa thay cho thay đổi như vậy nào
A. đều tăng.
B. đều hạn chế.
C. rất có thể tăng và rất có thể hạn chế.
D. ko tăng và cũng ko hạn chế.
Xem đáp án
Đáp án A
Khi hạ nhiệt chừng và tăng áp suất thì chừng tan của hóa học khí vô nước: đều tăng
Câu 7. Có một ly đựng hỗn hợp NaCl bão hòa ở sức nóng chừng chống. Làm thế này nhằm hỗn hợp cơ trở nên ko bão hòa?
Xem thêm: muối hành củ
A. Cho thêm thắt tinh anh thể NaCl vô hỗn hợp.
B. Cho thêm thắt nước chứa chấp vô hỗn hợp.
C. Đun rét hỗn hợp.
D. cả B và C đều đích.
Xem đáp án
Đáp án D
Để hỗn hợp cơ trở nên ko bão hòa tao rất có thể :
Cho thêm thắt nước chứa chấp vô hỗn hợp => tạo nên trở nên hỗn hợp loãng rộng lớn, rất có thể tan thêm thắt NaCl.
Đun rét hỗn hợp => chừng tan tăng, muối bột đem kỹ năng tan nhiều hơn nữa => tạo nên trở nên dd ko bão hòa
Câu 8. Hòa tan 14,36 gam NaCl vô 40 gam nước ở sức nóng chừng 20oC thì chiếm được hỗn hợp bão hòa. Độ tan của NaCl ở sức nóng chừng cơ là
A. 35,5 gam.
B. 35,9 gam.
C. 36,5 gam.
D. 37,2 gam.
Xem đáp án
Đáp án B
Hòa tan 14,36 gam NaCl vô 40 gam nước chiếm được hỗn hợp bão hòa
=> mct = 14,36 gam và mdm = 40 gam
Áp dụng công thức tính độ tan: S = mct/mdm.100 =14,36/40.100 = 35,9 gam
Câu 9. Chọn câu đúng vào khi nói đến chừng tan.
Độ tan của một hóa học nội địa ở sức nóng chừng xác lập là:
A. Số gam hóa học cơ tan vô 100g hỗn hợp.
B. Số gam hóa học cơ tan vô 100g dung môi
C. Số gam hóa học cơ tan nội địa dẫn đến 100g dung dịch
D. Số gam hóa học cơ tan vô 100g nước muốn tạo hỗn hợp bão hoà
Xem đáp án
Đáp án D
Độ tan của một hóa học nội địa ở sức nóng chừng xác lập là: Số gam hóa học cơ tan vô 100g nước muốn tạo hỗn hợp bão hoà
Câu 10. Nhận ấn định này tại đây đích về chừng tan một hóa học vô nước?
A. Chất rắn tan nội địa dựa vào áp suất.
B. Chất khí tan nội địa dựa vào thể tích nước.
C. Chất lỏng ko tan nội địa.
D. Chất rắn tan nội địa dựa vào sức nóng chừng.
Xem đáp án
Đáp án D
A sai vì như thế hóa học rắn tan nội địa dựa vào sức nóng chừng, ko dựa vào áp suất.
B sai vì như thế hóa học khí tan nội địa dựa vào áp suất.
C sai vì như thế hóa học lỏng rất có thể tan nội địa.
Câu 11. Chọn câu đúng vào khi nói đến chừng tan.Độ tan của một hóa học nội địa ở sức nóng chừng xác lập là:
A. Số gam hóa học cơ tan vô 100g hỗn hợp.
B. Số gam hóa học cơ tan vô 100g dung môi
C. Số gam hóa học cơ tan nội địa dẫn đến 100g dung dịch
D. Số gam hóa học cơ tan vô 100g nước muốn tạo hỗn hợp bão hoà
Câu 12. Các câu sau, câu này đúng vào khi khái niệm dung dịch?
A. Dung dịch là lếu láo ăn ý tương đồng của hóa học rắn và hóa học lỏng.
B. Dung dịch là lếu láo ăn ý tương đồng của hóa học khí và hóa học lỏng
C. Dung dịch là lếu láo ăn ý tương đồng của nhị hóa học lỏng.
D. Dung dịch là lếu láo ăn ý tương đồng của hóa học tan và dung môi
Câu 13. Độ tan của một hóa học nội địa ở sức nóng chừng xác lập là
A. Số gam hóa học cơ rất có thể tan vô 100 ml dung dịch
B. Số gam hóa học cơ rất có thể tan vô 100 ml nước.
C. Số gam hóa học cơ rất có thể tan vô 100 gam nước muốn tạo trở nên hỗn hợp bão hòa.
D. Số gam hóa học cơ rất có thể tan vô 100 gam dung môi muốn tạo trở nên hỗn hợp bão hòa
Xem đáp án
Đáp án C
Độ tan của một hóa học nội địa ở sức nóng chừng xác lập là số gam hóa học cơ rất có thể tan vô 100 gam nước muốn tạo trở nên hỗn hợp bão hòa
Câu 14. Tiến hành thực nghiệm nhỏ vài ba giọt hỗn hợp NaOH vô ống thử đựng sẵn hỗn hợp FeCl3, hiện tượng kỳ lạ để ý được là:
A. Xuất hiện nay kết tủa Trắng xanh rớt.
B. Có khí bay đi ra.
C. Xuất hiện nay kết tủa đỏ au nâu.
D. Xuất hiện nay Kết tủa white color.
Xem đáp án
Đáp án C
Cho hỗn hợp NaOH vô ống thử đựng hỗn hợp FeCl3, xẩy ra phản ứng:
3NaOH + FeCl3 → Fe(OH)3 ↓ + 3NaCl
Fe(OH)3 kết tủa red color nâ
Câu 15. Cho m gam Na2CO3 vô hỗn hợp HCl, sau phản xạ chiếm được 6,72 lít khí ở đktc. Giá trị của m là
A. 15,9 gam
B. 31,8 gam
C. 34,8 gam
D. 18,2 gam
Xem đáp án
Đáp án B
Phương trình phản xạ hóa học:
Na2CO3 + 2HCl → 2NaCl + CO2 ↑ + H2O
nCO2 = 6,72/22,4 = 0,3 mol
Theo phương trình hóa học:
nNa2CO3 = nCO2 = 0,3 mol
=> m = mNa2CO3 = 0,3.106 = 31,8 gam
Câu 16. Dãy chỉ bao gồm những hóa học tan chất lượng tốt vô nước?
A. Ba(OH)2, Mg(OH)2, Ca(OH)2, Sr(OH)2
BaSO4, MgSO4, CaSO4, SrSO4
Câu 17. Dãy bao gồm những muối bột đều tan nội địa là
A. CaCO3, BaCO3, Mg(HCO3)2, K2CO3.
B. CaCO3, BaCO3, NaHCO3, MgCO3.
C. Na2CO3, Ca(HCO3)2, Ba(HCO3)2, K2CO3.
D. BaCO3, NaHCO3, Mg(HCO3)2, Na2CO3.
Xem đáp án
Đáp án C
Một số muối bột cacbonat của sắt kẽm kim loại kiềm tan (Na2CO3, K2CO3,…) và đa số muối bột hiđrocacbonat tan nội địa (Ba(HCO3)2, Ca(HCO3)2, Mg(HCO3)2,NaHCO3,…)
Xem thêm: bánh trung thu đậu xanh
................................
Trên phía trên, VnDoc tiếp tục gửi cho tới chúng ta tư liệu Độ tan là gì? Công thức tính chừng tan. Hy vọng trải qua tư liệu này, những chúng ta cũng có thể bắt được những kiến thức và kỹ năng chủ yếu như Độ tan là gì, Công thức tính chừng tan, Những nguyên tố tác động cho tới chừng tan... Dường như những chúng ta cũng có thể áp dụng thực hiện những dạng bài bác tương quan cho tới chừng tan và công thức tính độ tan.
Để đem học tập chất lượng tốt Hóa 9 rộng lớn, những chúng ta cũng có thể tham lam khảo Hóa 9; Giải SBT Hóa 9; Trắc nghiệm Hóa học tập 9 được update liên tiếp bên trên VnDoc.













Bình luận